- ユニケミートップ
- Uni-Lab(分析技術情報)
- 周期表とは - 電子軌道から見た周期表 –
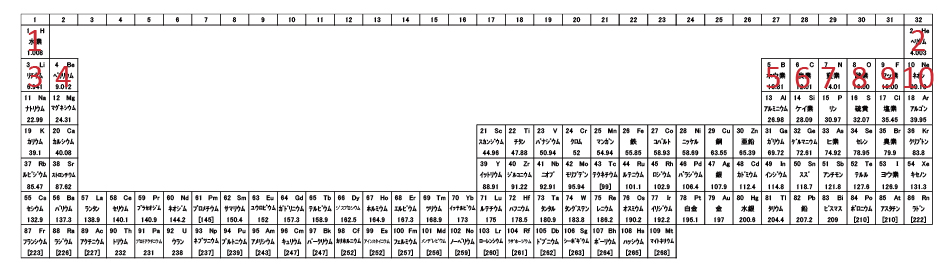
周期表とは - 電子軌道から見た周期表 –

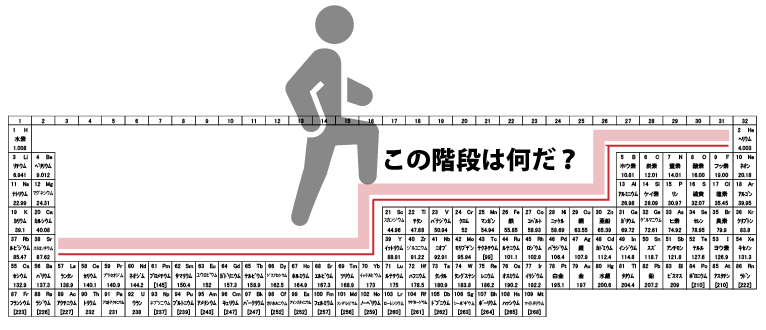
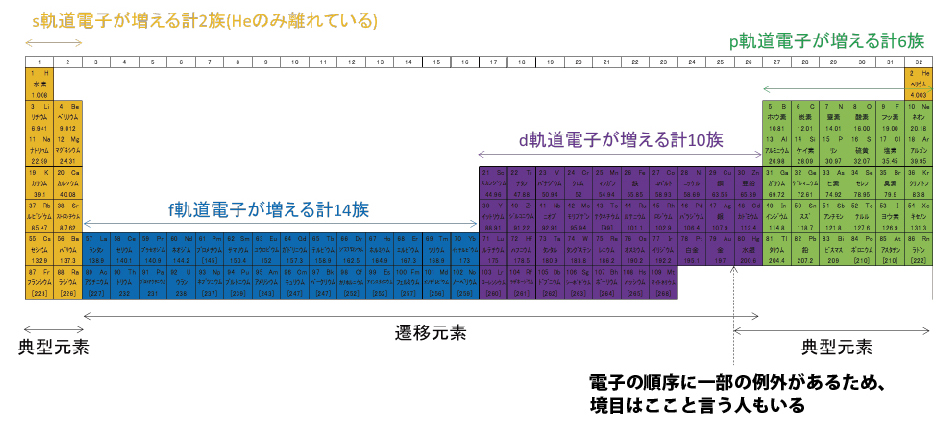
一昔前は1~8族の短周期表が一般的で、その方が電子配置を理解しやすいと思う人もいる。いつの頃からか、1~18族の長周期表が主流になった。敢えて、長周期表の脇に書かれているランタノイドとアクチノイドを組み込んで、1~32族の超長周期表を作ってみた。もしかすると、未来ではこれが普通になるかもしれない。長周期表の3~12族に凹があるが、超長周期表では階段が現れる。今回は、この隠し階段の謎に迫ってみたいと思う。
先に種明かしすると、隠し階段は電子軌道に由来する。
電子は素粒子の一つとされるため、まずは素粒子についての説明を試みる。 説明したいのだが、実のところ難しすぎて理解が及んでいない。興味本位で文献や書籍を読むことがあるが、私レベルの読解力ではファンタジー作品の一種。素粒子を分類すると下図になるが、加えて一部の素粒子には反粒子も存在する。
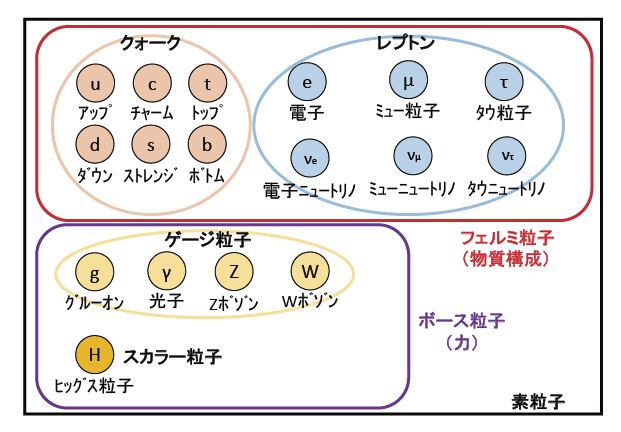
反粒子は正負が逆の粒子。例えば、プラスの電荷を持つ電子=陽電子などのこと。通常の粒子と反粒子が接触すると対消滅する。電子eはフェルミ粒子のレプトングループに属する。中性子はクォークのudd、陽子はuudで構成されている。中性子はベータ崩壊してe(β線)を放出するが、中性子内にeはない。唐突に、eが出現しdがuに変わる。素粒子は大きさのない点だと言う人も、極微小な粒だと言う人も、振動する紐だと言う人もいる。そもそも素粒子は3次元以上の存在らしく、3次元人が多次元を正確に観測し理解することは極めて困難なことだ。
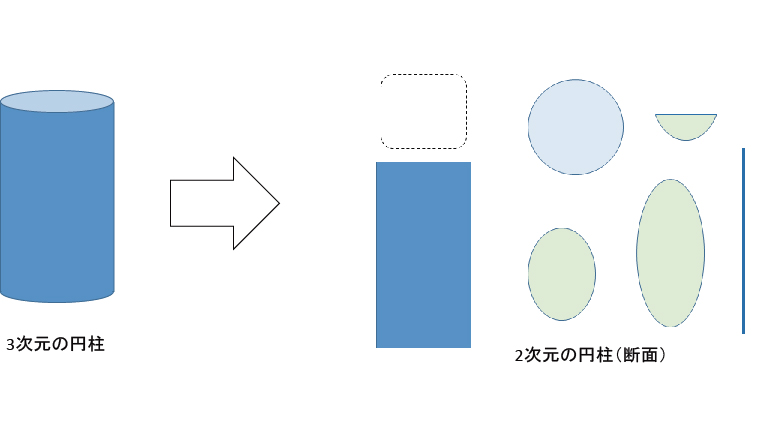
素粒子の不可解さを理解するために、3次元人が認識できる次元まで落として考えてみる。例えば、「2次元人が存在したとして、円柱を観測したらどうなるか?」と思考実験してみる。2次元では「何もない」、「長方形」、「円」、「大小楕円」、「半楕円」、「線」と観測されるだろう。このように上位次元の物質を下位次元から観察すると、色んな形のものが突然現れたように見えると想像できる。あなたが2次元人だったとして、果たして突然現れるこれらの物質が同じものと解るだろうか?
観測データを統計的に処理して正しく素粒子を分類するところまで、きっと現在の科学は辿り着いている。ただし、見えていない現象や統計の誤りもあるかもしれないため、素粒子の種類は時代とともに増減する可能性がある。素粒子は、そこに存在したりしなかったり、大きくなったり小さくなったり、何処にでもあるようで何処にもないようなもの。原子が実態(物質)と認識されるのは、何かの要因で素粒子が確率高く3次元に顔を出した状態と個人的には理解している。
モヤっとした前置きで申し訳ない。
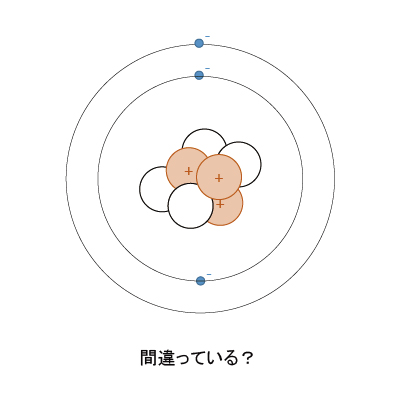
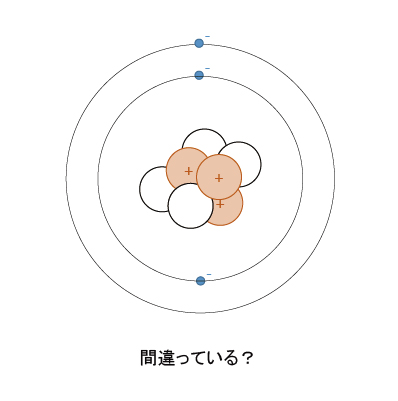
原子核の周りに電子が存在する様子を描いたものを目にするが、実は少し違う。こう考えると辻褄が合う現象があり重要な考え方ではあるが、説明できない問題も抱えている。例えば、「電子が移動すると磁場が発生する。電磁波の放出により電子はエネルギーを失い、減速して原子核に落下する。」と言う矛盾がある。電子について整理すると、以下の5つが挙げられる。
① 電荷が1である
② 質量がある
③ 核を中心とした殻が何層かある
④ 素粒子である
⑤ 波の性質を持つ
これらを包括して矛盾なく電子を原子核に束縛する「電子軌道※」という考え方がある。電子軌道はs,p,d,fの4種。理論上は更にg,h,i,k・・・(jを除いたアルファベット)と続くが、g軌道以降に電子が入った元素は確認されていない。(電子が入っていないg以降の軌道は存在する。)
※原子軌道とも言う。原子が持つ複数の軌道に電子が収まるため、原子軌道の方が正しいかもしれない。ここでは「電子の軌道」ということで電子軌道を使う。
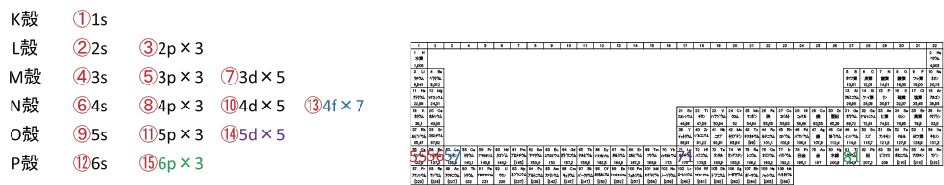
電子軌道の形
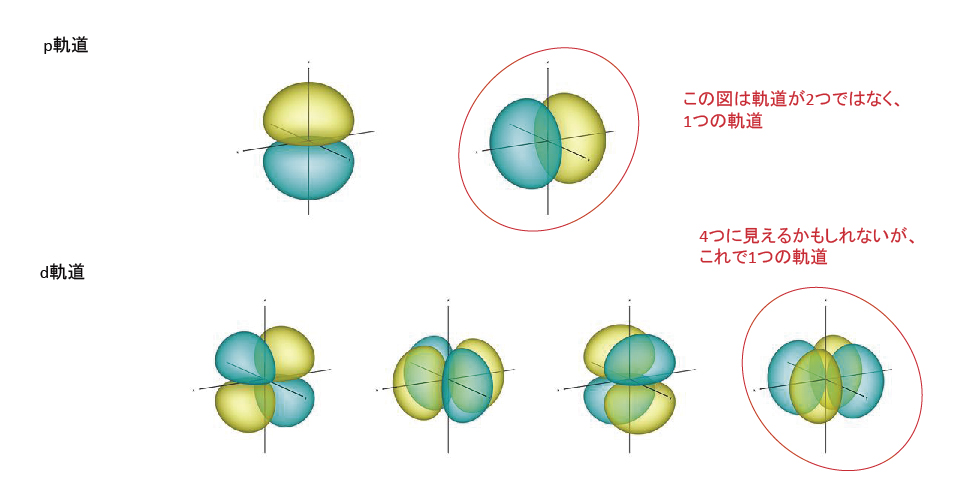
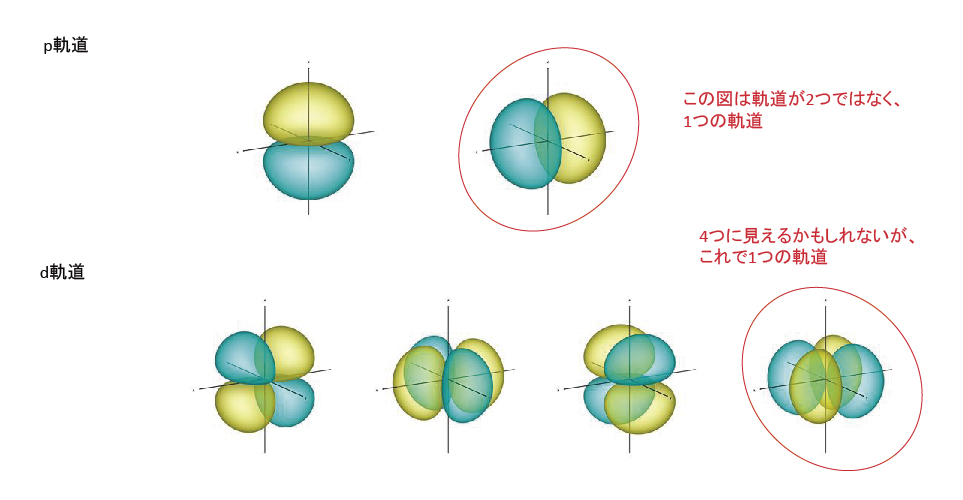
電子軌道は、それぞれ主量子数、方位量子数、磁気量子数によって規定され・・・・・。s軌道は球状が1つ、p軌道はx,y,z方向の計3つ、d軌道はxy,yz,zx,x2-y2,z2方向の計5つ、f軌道は・・・・・。(全部書くと長いし難しいので省略します。)他の軌道に干渉しない最小限の軌道を考えると、s,p,d,f,g・・・にはそれぞれ1,3,5,7,9・・・個の軌道を持つ。即ち、軌道数は2n-1で示される奇数の数列で表すことができる。s軌道以外は1つの図に複数の軌道があるように見えるかもしれませんが、1つの図は1つの軌道を示す。K殻にはs軌道のみ、L殻にはsとp軌道、M殻にはsとpとd軌道、といった具合に殻が1つ増えると軌道が1種増える。つまり、各殻の軌道数を合計すると、K殻は1、L殻は1+3、M殻は1+3+5、・・・・、n番目までの奇数の和になる。n番目までの奇数の和はn2で1つの軌道に電子が2個収容できるため、各殻には最大2n2個の電子が収容される。したがって、各殻に収容される最大電子数は、K殻に2個、L殻に8個、M殻に18個、N殻に32個・・・と続く。
s軌道
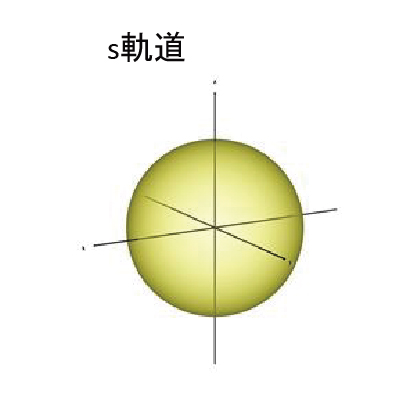
この軌道の中を電子が移動するのではなく、電子の存在する確率的な範囲※を示す。電子は素粒子なため、軌道内のどこにでもいるようで、どこにもいない、あるいは全域に存在する。粒が瞬間移動したり、分裂したりするのでもない。電子は運動していないため、磁場は発生しない。3次元人の感性に無理やり当てはめると、「雲」が最も近い。雲だからモヤっとしたままでいいのだ。深く理解せずに、電子は「こんな形の雲」と考えても間違いではない。
※電子軌道はシュレーディンガー方程式により導き出された波動関数が与える確率密度関数で示される。要約すると、難しい理論で作られた3Dグラフということ。計算上、この範囲に電子があると3次元的に示したもの。
p軌道、d軌道とf軌道
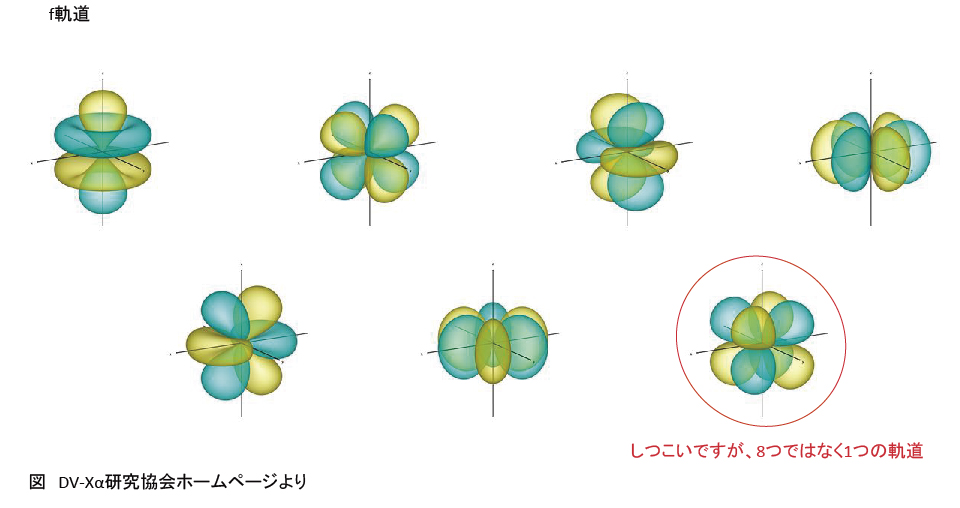
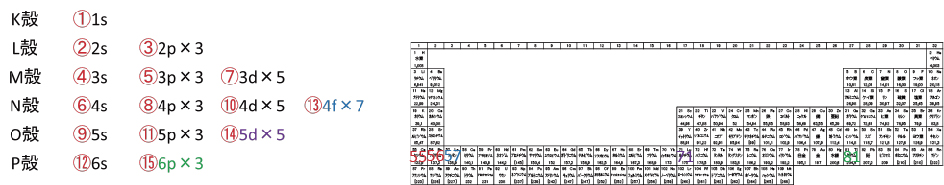
K殻にはs軌道が、L殻にはsとpが、・・・、s軌道は1つ、p軌道は3つの・・・を表にすると以下になる。一部の例外を除き、基本的に電子の収容順は右上から左下となっている。(①~⑲の順)電子の気持ちになって「同じフロアの狭い椅子に座るぐらいなら、最寄りの別フロアにある広い椅子の方がいい。」と考えれば妥当な順番に思える。
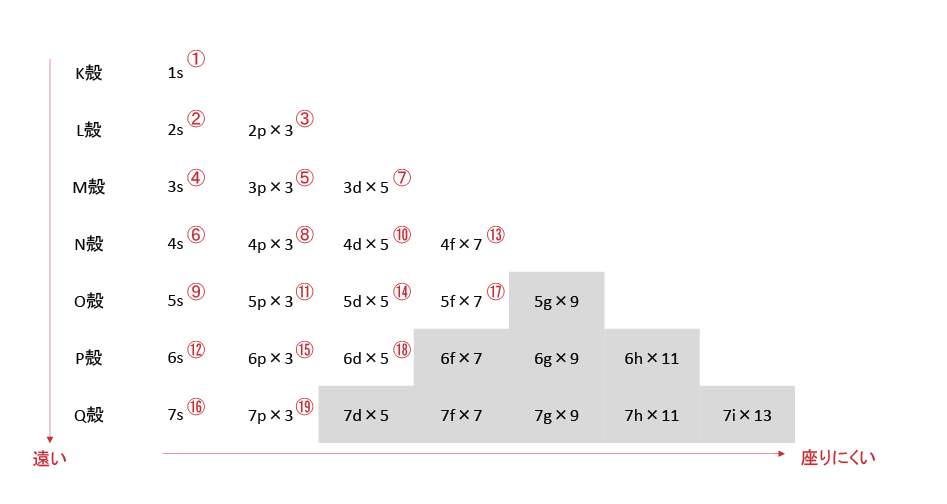
K殻のs軌道を1s、L殻のs軌道を2s、p軌道を2p・・・と示す。×の後ろにある数字は軌道数を示す。各軌道に電子は2個入るため、電子数はこの2倍となる。このルールだと最外殻の電子が入っている軌道はsとpになり、「最外殻の電子数は8個まで」となる。⑲以降に電子が入っている元素は発見されていない。電子が入っていない軌道があると考える。
ルールに従って、順に電子を入れてみる。
原子番号 1 の水素には電子が1個あり、K殻の1s軌道に電子が1個入る。この文章を記号で表すと→

原子番号 2 のヘリウムには電子が2個あり、 K殻の1s軌道に電子が2個入る。s軌道に電子は2個までのため、K殻は閉じる。殻が閉じた元素は貴ガス。

原子番号 3 のリチウムには電子が3個あり、K殻の1s軌道に電子が2個とL殻の2s軌道に電子が1個入る。

原子番号 4 のベリリウムには電子が4個あり、K殻の1s軌道に2個とL殻の2s軌道に2個入る。s軌道は閉じる。

原子番号 5 のホウ素には電子が5個あり、K殻の1s軌道に2個とL殻の2s軌道に2個とL殻の2p軌道に電子が1個入る。

原子番号 6 の炭素には電子が6個あり、K殻の1s軌道に2個とL殻の2s軌道に2個とL殻の2p軌道に電子が2個入る。

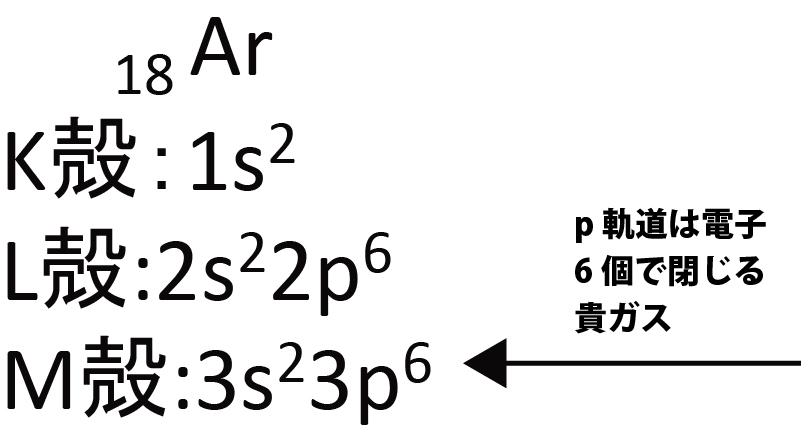
原子番号7~10 (N~Ne) も同様に、2p電子が増える。 p軌道は3つ、1つの軌道に2個の電子が入るため計6個の電子=2p6で閉じる。




HeとNeは最外殻の軌道が電子で満たされている。⇒貴ガス
次に、原子番号11,12,13,18のナトリウム,マグネシウム,アルミニウム,アルゴンの軌道に電子を入れてみる。






3pが閉じると、次はN殻の4sに電子が入るため、原子番号19,20のカリウムとカルシウムはこうなる。
原子番号21のスカンジウムでは、4sの次に3dへ電子が入る。d軌道は5つあり各2個の電子が入るため、原子番号30の亜鉛までd軌道電子が10個増える。その後は4pに電子が入る。




一部の例外元素は、導電率Top3の金属。電子配置と自由電子の自由度に関係があるのかもしれない。
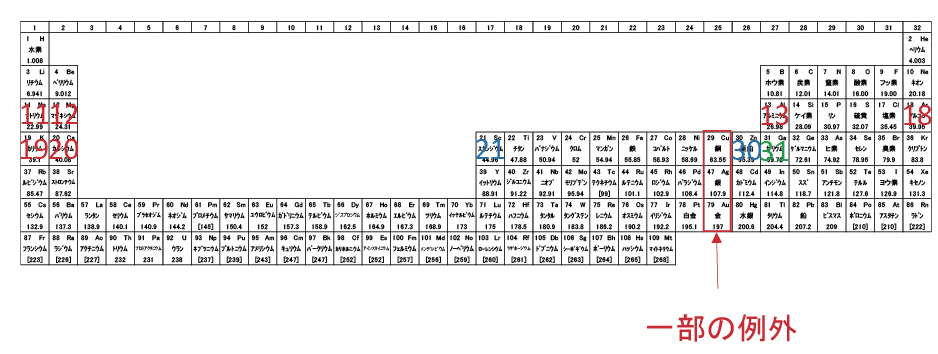
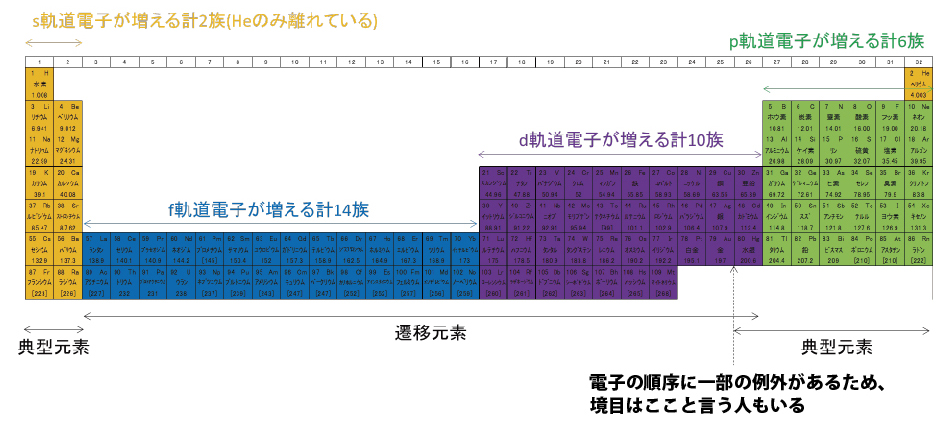
一部の例外を除いて、原子番号21~30の10元素はd軌道電子が増え、最外殻の電子数は変化しない。
d軌道の電子が増える区間は最外殻の電子数が増えないため、周期表の左右で性質の変化は少ない。このような元素は「遷移元素」と呼ばれる。対して、最外殻の電子数が増える区間は周期表の上下で性質が似ており、「典型元素」と呼ばれる。
慣れてきたころところで、1行とばして原子番号55以降の各軌道に電子を入れてみる。原子番号55,56では6s軌道に電子が入り、原子番号57~70の14元素は4f軌道の電子が増える。4f軌道が満たされると、次に5d軌道、その次に6p軌道へ電子が入る。
原子番号55セシウム
原子番号56バリウム


原子番号57ランタンブロックの追加


ルールその1:右上から左下へ順に軌道が閉じるまで電子が入る。
ルールその2:s,p,d,fにはそれぞれ1,3,5,7個の軌道がある。
ルールその3:1つの軌道に2個の電子が入る。ブロックの追加
原子番号71ルテチウム


ルールその4: s,p,d,fにそれぞれ2,6,10,14個の電子が入ると、その軌道は閉じるブロックの追加
原子番号81タリウム


ブロックの追加ブロックの追加
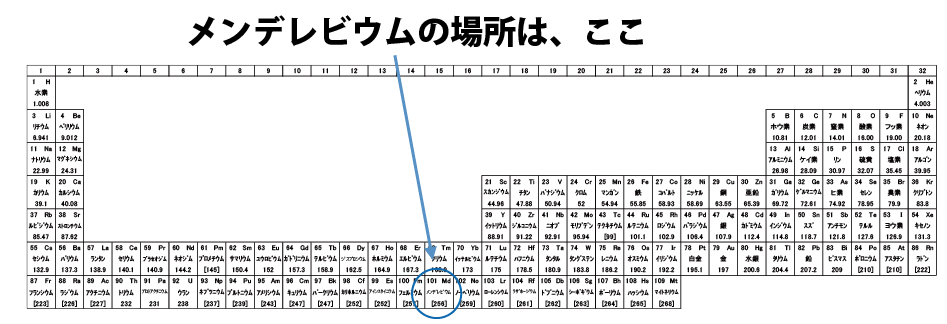
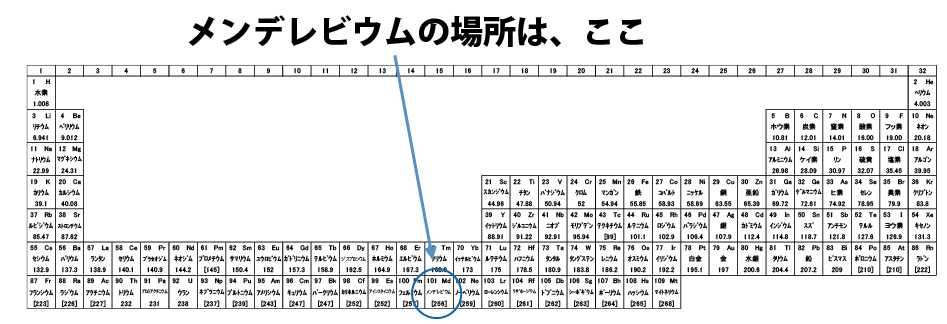
折角なので、メンデレーエフにちなんで命名された原子番号101メデレビウムの電子配置を考える。①~⑲は電子が入る順番、数字は電子数を示す。Excelで各殻の右列に電子数小計、一番下に電子数合計が表示されるように関数(=SUM)を入力しておく。
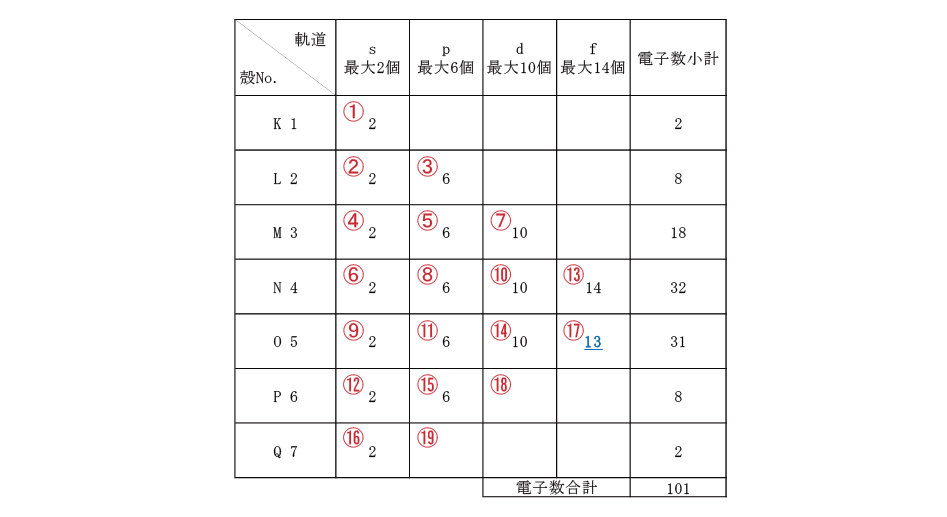
順番に電子を入れて、電子数合計が原子番号と同じ101になったら終了。これがメンデレビウムの電子配置になる。Q殻まで数値が入っているため周期表の上から7番目(一番下)の行、⑰のf軌道電子が13個なため階段左から13番目と解る。(f軌道の終わりから1つ手前)このように、電子配置と周期表の位置には密接な関係がある。
隠し階段は電子軌道が作ったものだった。s軌道に2個の電子、3つのp軌道に6個の電子、5つのd軌道に10個の電子、7つのf軌道に14個の電子、それぞれが階段の幅に該当している。モヤっとでも電子軌道のことを知っていると、周期表が今までと違う景色に見えませんか?
メンデレーエフの周期表に端を発し、新元素発見の可能性が見出された。新元素探求の過程で放射線が見つかり、放射線により原子核の存在が明らかになり「これ以上壊れない最小単位とされた原子」が電子と原子核に分かれた。現在は、電子と原子核の不思議な挙動から素粒子理論まで発展している。
周期表の発見から、およそ150年。自分が蒔いた種が育つのを、きっとメンデレーエフは楽しんでいることだろう。パネルを閉じる: SEO設定
SEO設定
タイトル説明文パネルを閉じる: 分析技術情報 – 詳細設定
分析技術情報 – 詳細設定
投稿者設定
| アイコン画像 | 名前 | ローマ字 |
|---|---|---|
| 画像が選択されていません 画像を追加する |
パネルを閉じる: 計測データ
計測データ
アクセス数ドキュメント設定を開く公開パネルを開く
- 文書
素粒子の不可解さを理解するために、3次元人が認識できる次元まで落として考えてみる。例えば、「2次元人が存在したとして、円柱を観測したらどうなるか?」と思考実験してみる。2次元では「何もない」、「長方形」、「円」、「大小楕円」、「半楕円」、「線」と観測されるだろう。このように上位次元の物質を下位次元から観察すると、色んな形のものが突然現れたように見えると想像できる。あなたが2次元人だったとして、果たして突然現れるこれらの物質が同じものと解るだろうか?

観測データを統計的に処理して正しく素粒子を分類するところまで、きっと現在の科学は辿り着いている。ただし、見えていない現象や統計の誤りもあるかもしれないため、素粒子の種類は時代とともに増減する可能性がある。素粒子は、そこに存在したりしなかったり、大きくなったり小さくなったり、何処にでもあるようで何処にもないようなもの。原子が実態(物質)と認識されるのは、何かの要因で素粒子が確率高く3次元に顔を出した状態と個人的には理解している。
モヤっとした前置きで申し訳ない。
原子核の周りに電子が存在する様子を描いたものを目にするが、実は少し違う。こう考えると辻褄が合う現象があり重要な考え方ではあるが、説明できない問題も抱えている。例えば、「電子が移動すると磁場が発生する。電磁波の放出により電子はエネルギーを失い、減速して原子核に落下する。」と言う矛盾がある。電子について整理すると、以下の5つが挙げられる。
① 電荷が1である
② 質量がある
③ 核を中心とした殻が何層かある
④ 素粒子である
⑤ 波の性質を持つ
これらを包括して矛盾なく電子を原子核に束縛する「電子軌道※」という考え方がある。電子軌道はs,p,d,fの4種。理論上は更にg,h,i,k・・・(jを除いたアルファベット)と続くが、g軌道以降に電子が入った元素は確認されていない。(電子が入っていないg以降の軌道は存在する。)
※原子軌道とも言う。原子が持つ複数の軌道に電子が収まるため、原子軌道の方が正しいかもしれない。ここでは「電子の軌道」ということで電子軌道を使う。
電子軌道の形
電子軌道は、それぞれ主量子数、方位量子数、磁気量子数によって規定され・・・・・。s軌道は球状が1つ、p軌道はx,y,z方向の計3つ、d軌道はxy,yz,zx,x2-y2,z2方向の計5つ、f軌道は・・・・・。(全部書くと長いし難しいので省略します。)他の軌道に干渉しない最小限の軌道を考えると、s,p,d,f,g・・・にはそれぞれ1,3,5,7,9・・・個の軌道を持つ。即ち、軌道数は2n-1で示される奇数の数列で表すことができる。s軌道以外は1つの図に複数の軌道があるように見えるかもしれませんが、1つの図は1つの軌道を示す。K殻にはs軌道のみ、L殻にはsとp軌道、M殻にはsとpとd軌道、といった具合に殻が1つ増えると軌道が1種増える。つまり、各殻の軌道数を合計すると、K殻は1、L殻は1+3、M殻は1+3+5、・・・・、n番目までの奇数の和になる。n番目までの奇数の和はn2で1つの軌道に電子が2個収容できるため、各殻には最大2n2個の電子が収容される。したがって、各殻に収容される最大電子数は、K殻に2個、L殻に8個、M殻に18個、N殻に32個・・・と続く。
s軌道
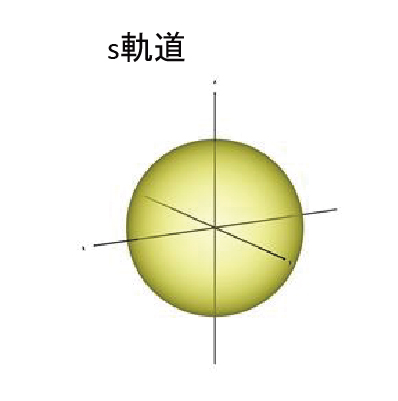
この軌道の中を電子が移動するのではなく、電子の存在する確率的な範囲※を示す。電子は素粒子なため、軌道内のどこにでもいるようで、どこにもいない、あるいは全域に存在する。粒が瞬間移動したり、分裂したりするのでもない。電子は運動していないため、磁場は発生しない。3次元人の感性に無理やり当てはめると、「雲」が最も近い。雲だからモヤっとしたままでいいのだ。深く理解せずに、電子は「こんな形の雲」と考えても間違いではない。
※電子軌道はシュレーディンガー方程式により導き出された波動関数が与える確率密度関数で示される。要約すると、難しい理論で作られた3Dグラフということ。計算上、この範囲に電子があると3次元的に示したもの。
p軌道、d軌道とf軌道
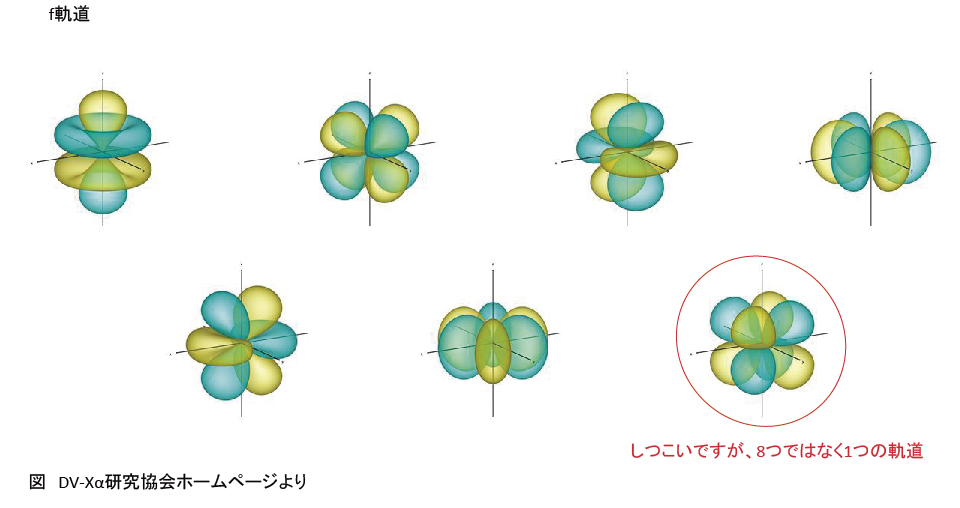
K殻にはs軌道が、L殻にはsとpが、・・・、s軌道は1つ、p軌道は3つの・・・を表にすると以下になる。一部の例外を除き、基本的に電子の収容順は右上から左下となっている。(①~⑲の順)電子の気持ちになって「同じフロアの狭い椅子に座るぐらいなら、最寄りの別フロアにある広い椅子の方がいい。」と考えれば妥当な順番に思える。
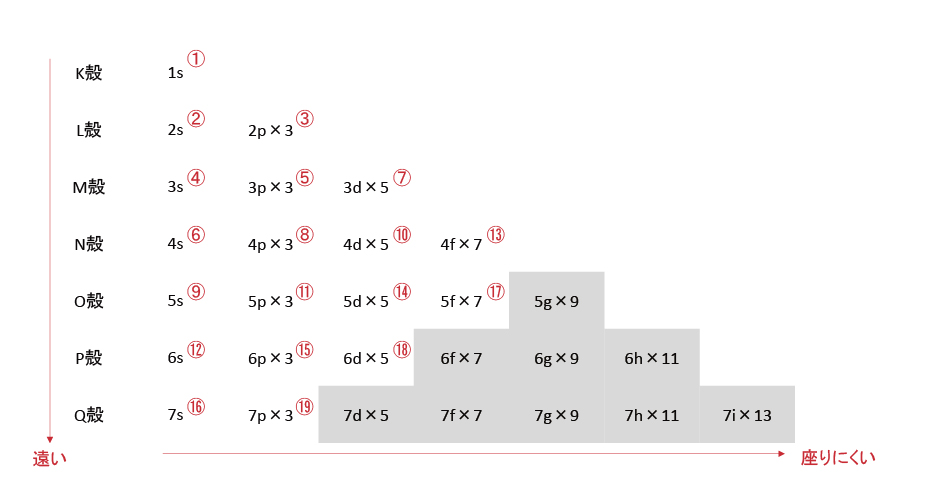
K殻のs軌道を1s、L殻のs軌道を2s、p軌道を2p・・・と示す。×の後ろにある数字は軌道数を示す。各軌道に電子は2個入るため、電子数はこの2倍となる。このルールだと最外殻の電子が入っている軌道はsとpになり、「最外殻の電子数は8個まで」となる。⑲以降に電子が入っている元素は発見されていない。電子が入っていない軌道があると考える。
ルールに従って、順に電子を入れてみる。
原子番号 1 の水素には電子が1個あり、K殻の1s軌道に電子が1個入る。この文章を記号で表すと→

原子番号 2 のヘリウムには電子が2個あり、 K殻の1s軌道に電子が2個入る。s軌道に電子は2個までのため、K殻は閉じる。殻が閉じた元素は貴ガス。

原子番号 3 のリチウムには電子が3個あり、K殻の1s軌道に電子が2個とL殻の2s軌道に電子が1個入る。

原子番号 4 のベリリウムには電子が4個あり、K殻の1s軌道に2個とL殻の2s軌道に2個入る。s軌道は閉じる。

原子番号 5 のホウ素には電子が5個あり、K殻の1s軌道に2個とL殻の2s軌道に2個とL殻の2p軌道に電子が1個入る。

原子番号 6 の炭素には電子が6個あり、K殻の1s軌道に2個とL殻の2s軌道に2個とL殻の2p軌道に電子が2個入る。

原子番号7~10 (N~Ne) も同様に、2p電子が増える。 p軌道は3つ、1つの軌道に2個の電子が入るため計6個の電子=2p6で閉じる。




HeとNeは最外殻の軌道が電子で満たされている。⇒貴ガス
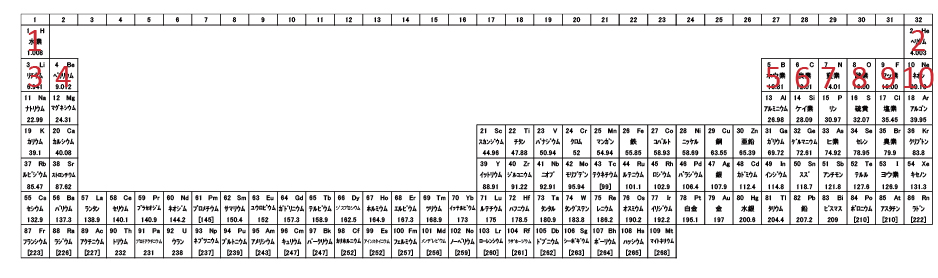
次に、原子番号11,12,13,18のナトリウム,マグネシウム,アルミニウム,アルゴンの軌道に電子を入れてみる。







3pが閉じると、次はN殻の4sに電子が入るため、原子番号19,20のカリウムとカルシウムはこうなる。
原子番号21のスカンジウムでは、4sの次に3dへ電子が入る。d軌道は5つあり各2個の電子が入るため、原子番号30の亜鉛までd軌道電子が10個増える。その後は4pに電子が入る。




一部の例外元素は、導電率Top3の金属。電子配置と自由電子の自由度に関係があるのかもしれない。
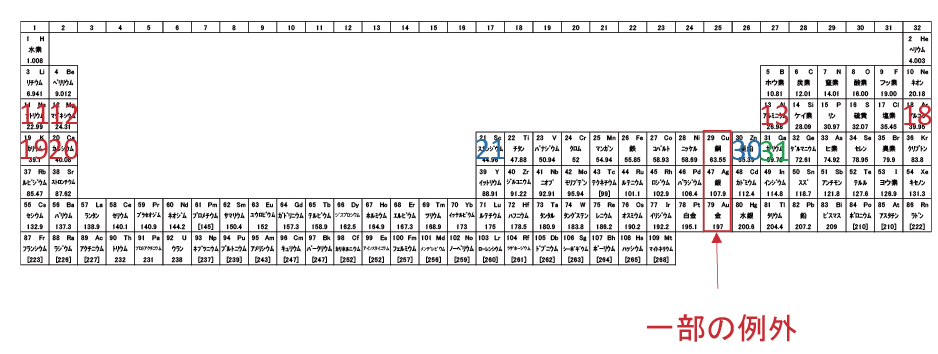
一部の例外を除いて、原子番号21~30の10元素はd軌道電子が増え、最外殻の電子数は変化しない。
d軌道の電子が増える区間は最外殻の電子数が増えないため、周期表の左右で性質の変化は少ない。このような元素は「遷移元素」と呼ばれる。対して、最外殻の電子数が増える区間は周期表の上下で性質が似ており、「典型元素」と呼ばれる。
慣れてきたころところで、1行とばして原子番号55以降の各軌道に電子を入れてみる。原子番号55,56では6s軌道に電子が入り、原子番号57~70の14元素は4f軌道の電子が増える。4f軌道が満たされると、次に5d軌道、その次に6p軌道へ電子が入る。
原子番号55セシウム
原子番号56バリウム


原子番号57ランタン


ルールその1:右上から左下へ順に軌道が閉じるまで電子が入る。
ルールその2:s,p,d,fにはそれぞれ1,3,5,7個の軌道がある。
ルールその3:1つの軌道に2個の電子が入る。
原子番号71ルテチウム


ルールその4: s,p,d,fにそれぞれ2,6,10,14個の電子が入ると、その軌道は閉じる
原子番号81タリウム


折角なので、メンデレーエフにちなんで命名された原子番号101メデレビウムの電子配置を考える。①~⑲は電子が入る順番、数字は電子数を示す。Excelで各殻の右列に電子数小計、一番下に電子数合計が表示されるように関数(=SUM)を入力しておく。
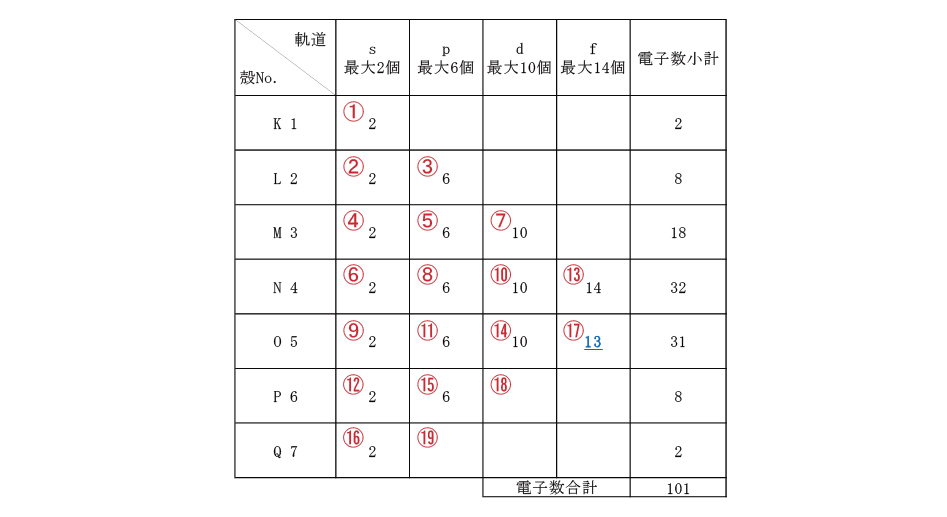
順番に電子を入れて、電子数合計が原子番号と同じ101になったら終了。これがメンデレビウムの電子配置になる。Q殻まで数値が入っているため周期表の上から7番目(一番下)の行、⑰のf軌道電子が13個なため階段左から13番目と解る。(f軌道の終わりから1つ手前)このように、電子配置と周期表の位置には密接な関係がある。
隠し階段は電子軌道が作ったものだった。s軌道に2個の電子、3つのp軌道に6個の電子、5つのd軌道に10個の電子、7つのf軌道に14個の電子、それぞれが階段の幅に該当している。モヤっとでも電子軌道のことを知っていると、周期表が今までと違う景色に見えませんか?
メンデレーエフの周期表に端を発し、新元素発見の可能性が見出された。新元素探求の過程で放射線が見つかり、放射線により原子核の存在が明らかになり「これ以上壊れない最小単位とされた原子」が電子と原子核に分かれた。現在は、電子と原子核の不思議な挙動から素粒子理論まで発展している。
周期表の発見から、およそ150年。自分が蒔いた種が育つのを、きっとメンデレーエフは楽しんでいることだろう。
RANKING 人気事例ランキング
-
 1
1 -
 2
2 -
 3
3 -
 4
4 -
 5
5
TAG LIST