- ユニケミートップ
- Uni-Lab(分析技術情報)
- 周期表とは - 電子殻から見た周期表 –
周期表とは - 電子殻から見た周期表 –

原子核は陽子と中性子から成り、周期表は陽子数順に書かれている。イオンでない原子の陽子と電子は、当然に同じ数になる。
つまり、周期表は電子数順に配列されているとも言える。
下に、水素 , ヘリウム , リチウム , ネオンの原子モデルを示す。
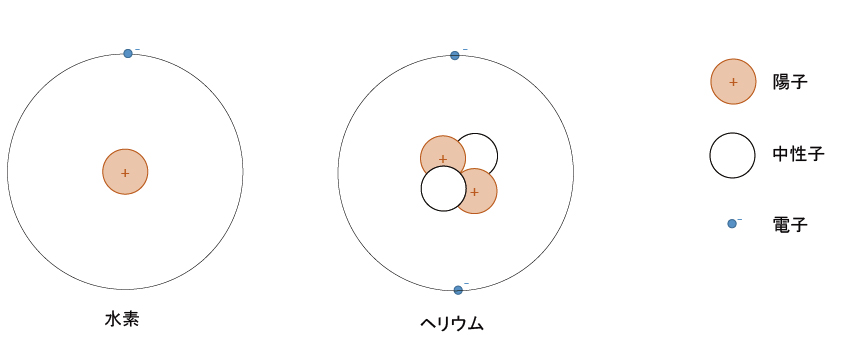
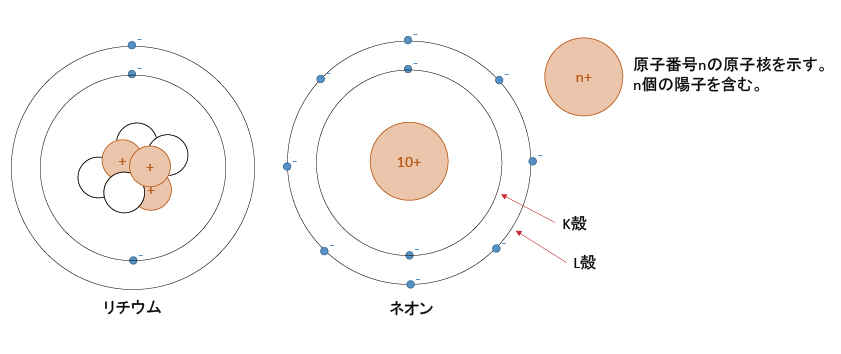
本当は、電子は原子核を中心とした円周上を移動していない。(太陽と惑星のようではない。)電子は微小な粒子でないかもしれない。(大きさがあるのかないのか判明していない。)
ただし、このモデルで説明できる現象があるため、重要な考え方である。内側からK殻 , L殻 , M殻 , ・ ・ ・と続く。(何故Kから始まるのかは不明。)n番目の殻には2n2個の電子が収容可能で、最外殻には8個までという規則性がある。
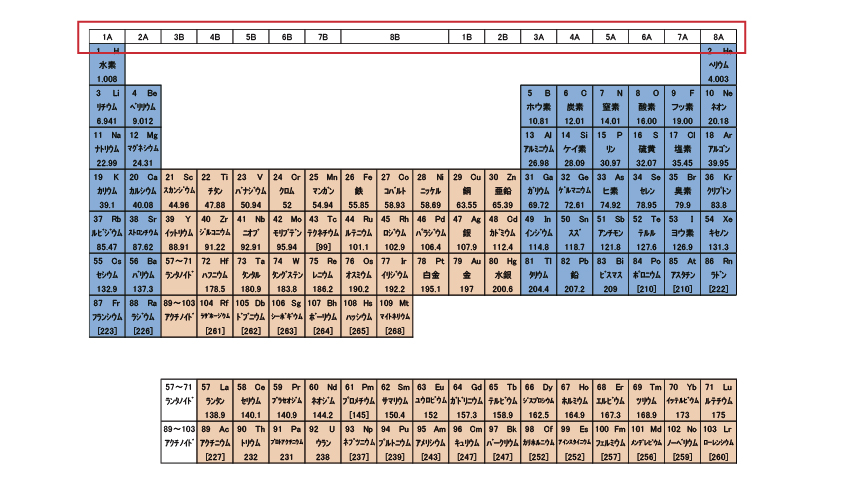
いつの頃からから、周期表と言えば1~18族までの「長周期表」を指すようになった。
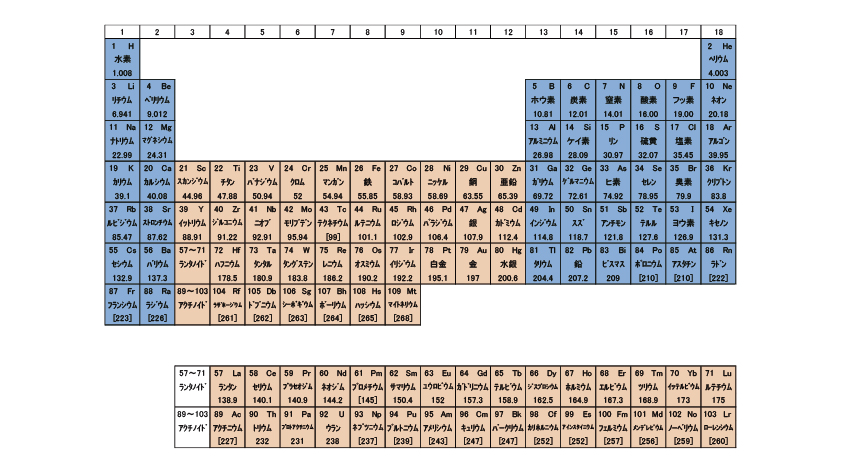
筆者が習ったのは、1~8族までの「短周期表」だった。赤枠の部分が長周期表と異なる。B群の数字が違っていたり、8を0と習った人もいると思うが、かつては18族ではなかった。
原子番号1の水素から18のアルゴンまでを抜粋し、電子配置を描いてみた。
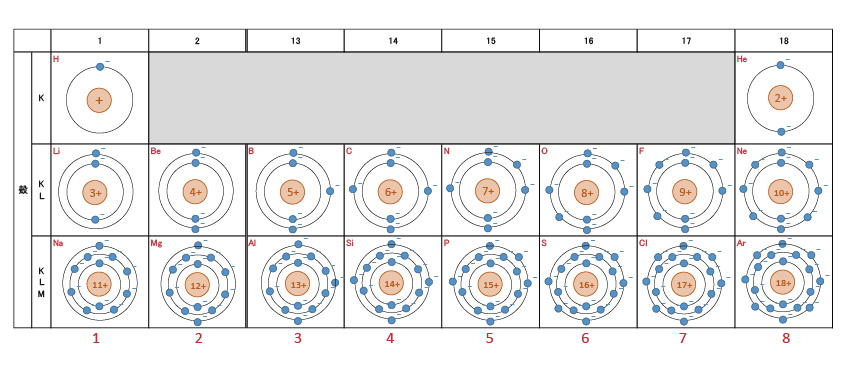
欄外の赤い数字は短周期表の「族」を示す。短周期表では行が殻の数、列(族)が最外殻の電子数を示していた。長周期表より短周期表の方が理解しやすい。と、一昔前の人は言うだろう。また、最外殻の電子数は元素の性質に大きな影響あたえるため、同族元素は似た性質を持つ。
最右列の18族(短周期表では8族)は貴ガスとよばれ、反応性が無く、単原子の気体として存在する。それは、最外殻が電子で満たされているためである。
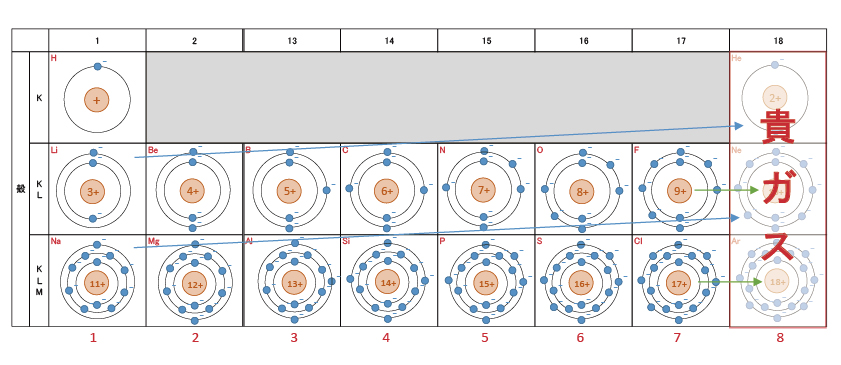
貴ガス以外は安定を求めて電子を放出または受け取り、最寄りの貴ガス同じ電子配置のイオンになる元素がある。例えば、Naは電子を1つ放出しNa+になると、Neと同じ電子配置となる。Fは電子を1つ受け取りF–になると、Neと同じ電子配置になる。つまり、Na+とF–の電子配置は同じになる。どの元素が陽イオンになるのか陰イオンになるのか、その価数も最外殻の電子で判断することができる。
「なぜ、電子殻は間隔を空けるのか?」「電子は人工衛星のように任意の高さを周回しないのか?」と疑問に思ったことはないだろうか。
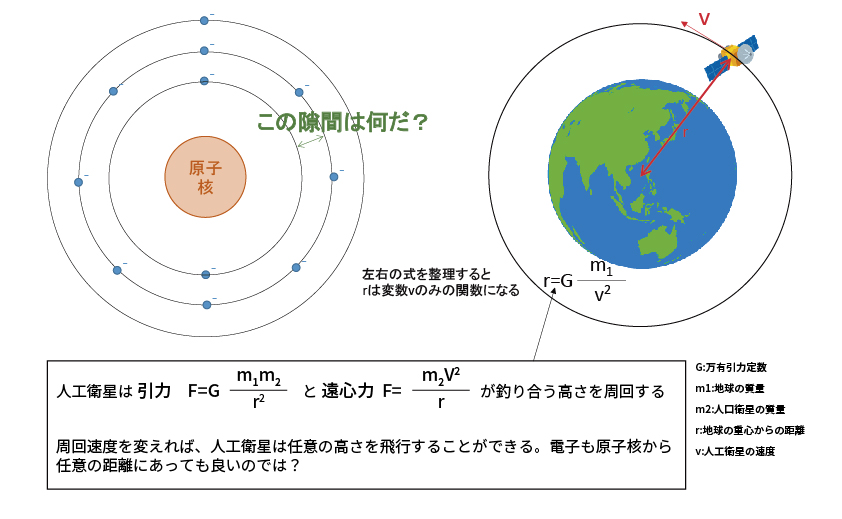
突然ですが、これら3つの式を眺めてみる。
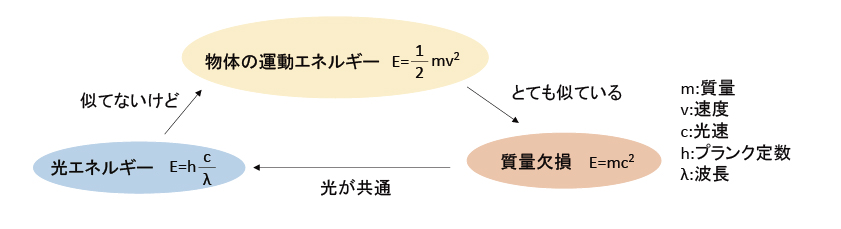
これら3つの式を見比べる「高速(光速)で移動する物体は光(波)の性質を持つ」と考えられないこともない。電子が波の性質を持つと考えた場合、次の条件が決まる。
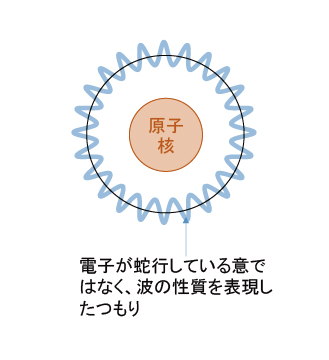
電子が原子核を1周するときに、波の最初と最後が繋がる必要がある。そのため、円周は電子の波長を自然数倍した長さでなければならない。
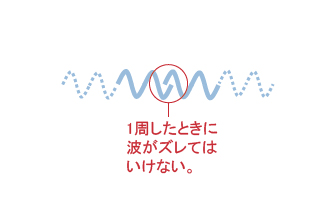
つまり、電子殻の隙間は電子の持つ波の性質に由来し、電子は任意の位置を周回できない。
電子は波の性質を持つが故に、原子核から特定の距離に縛られて移動することしかできない。
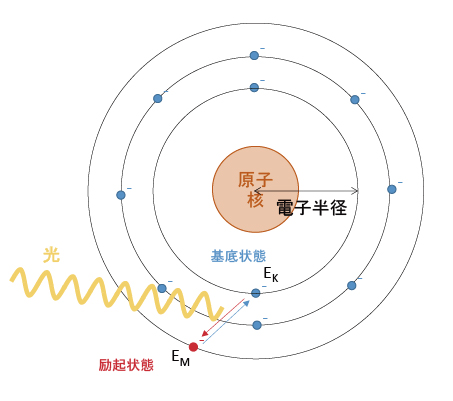
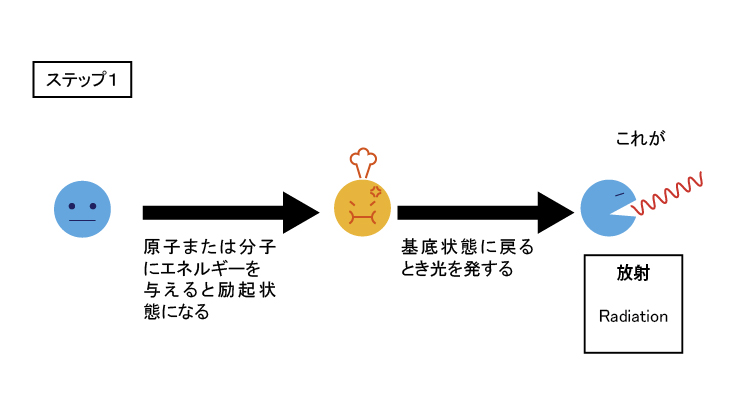
それぞれの殻にある電子は、原子核からの距離に応じた位置エネルギーを持っている。原子に過大なエネルギーを加えると、励起状態になる。励起状態の一つに、「電子の引っ越し」がある。励起状態では、他の殻へ電子が移動した状態になる。
例えば、励起状態でK殻にあった電子がM殻へ移動したとする。励起状態は不安定なため基底状態へ戻り、電子もM殻からK殻へ戻る。K殻の位置エネルギーをEK、M殻の位置エネルギーをEMとする。電子が戻る際に差分エネルギーΔE=EM-EKを光として放出する。電子半径は陽子数よって異なる。つまり、元素によってΔEは固有の値となるめ、元素ごとに特定波長の光を放出する。
これがICPなど発光分析の原理になっている。
励起状態の元素が光を放つ性質を利用し、汎用している機器にレーザーが挙げられる。レーザー(Laser)は、「Light Amplification by Stimulated Emission of Radiation」の略。直訳すると、「放射の誘導放出による光増幅」になるが、かえって意味が分からなくなる。
プロセスをイメージにすると
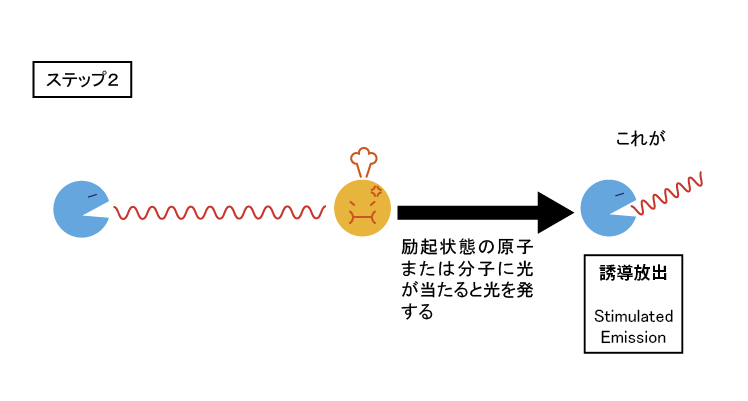
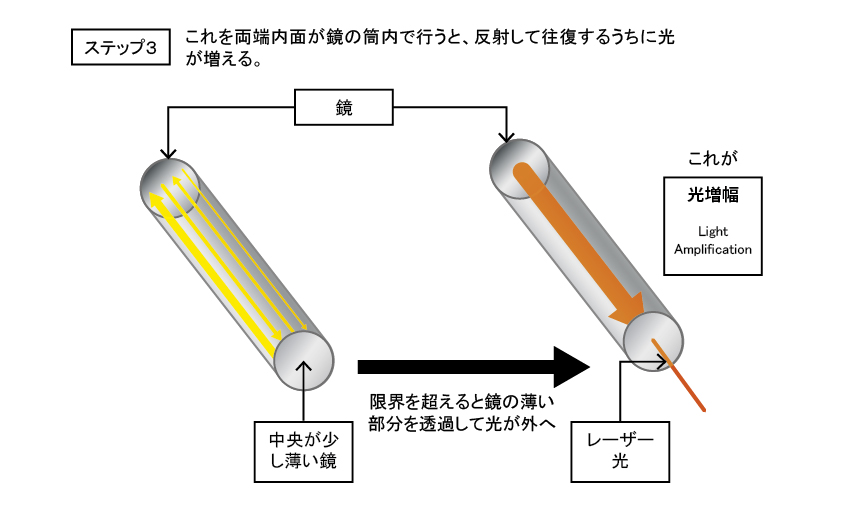
過剰のエネルギーを使って発生した光の大部分を捨てて、無理して作った光がレーザー光。ただし、向きと波長と位相が揃っているため、指向性が高く遠くまで届く特別な光。

周期表は電子数順に並んでいる。メンデレーエフが「性質が似ている」と感じた元素を横に並べた。
横並びの元素は、最外殻の電子数が同じものが多い。縦方向は電子殻数が同じものが多い。
結果的に、メンデレーエフは電子配置も予言したことになる。本人は知る由もないが、この表が物理化学の大いなる発展の引き金になったことは間違いない。
RANKING 人気事例ランキング
-
 1
1 -
 2
2 -
 3
3 -
 4
4 -
 5
5
TAG LIST